2025年7月�����,“全球首個(gè)”中美藥監(jiān)局雙報(bào)雙批注冊(cè)臨床試驗(yàn)——“臨床級(jí)iPSC衍生亞型脊髓神經(jīng)前體細(xì)胞治療脊髓損傷”項(xiàng)目完成里程碑進(jìn)展:由士澤生物自主研發(fā)的“全球首款”異體通用“現(xiàn)貨型”iPSC再生脊髓神經(jīng)細(xì)胞新藥(XS228細(xì)胞注射液)治療重大神經(jīng)系統(tǒng)疾病脊髓損傷的注冊(cè)臨床I期研究�,在中山大學(xué)附屬第三醫(yī)院(中山三院)召開(kāi)臨床啟動(dòng)會(huì)�,并成功完成“全球首例”受試者給藥。
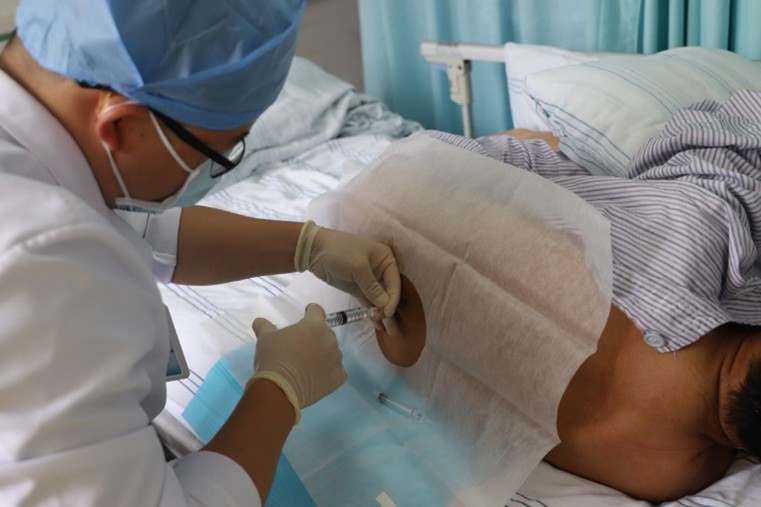
注冊(cè)臨床試驗(yàn)首例受試者接受臨床級(jí)iPS再生脊髓神經(jīng)細(xì)胞移植后��,無(wú)手術(shù)及圍術(shù)期的并發(fā)癥或其他不良安全事件,各項(xiàng)檢測(cè)指標(biāo)正常���,平穩(wěn)度過(guò)觀(guān)察期并進(jìn)入正式隨訪(fǎng)期�����。

士澤生物自主研發(fā)的“全球首款”異體通用“現(xiàn)貨型”iPSC再生脊髓神經(jīng)細(xì)胞新藥治療重大神經(jīng)系統(tǒng)疾病脊髓損傷的注冊(cè)臨床I期研究的臨床合作方為國(guó)內(nèi)脊髓損傷診療領(lǐng)域頂級(jí)醫(yī)院及專(zhuān)家團(tuán)隊(duì):
牽頭臨床單位:中山大學(xué)附屬第三醫(yī)院���,由脊髓損傷診療領(lǐng)域權(quán)威專(zhuān)家、骨科學(xué)科帶頭人戎利民院長(zhǎng)及其團(tuán)隊(duì)
聯(lián)合臨床單位:大連醫(yī)科大學(xué)附屬第一醫(yī)院及大連干細(xì)胞與精準(zhǔn)醫(yī)學(xué)創(chuàng)新研究院��,由黨委書(shū)記��、院長(zhǎng)劉晶教授及其團(tuán)隊(duì)
中山大學(xué)附屬第三醫(yī)院院長(zhǎng)戎利民教授在注冊(cè)臨床啟動(dòng)會(huì)表示:由中山大學(xué)附屬第三醫(yī)院牽頭開(kāi)展的全球首個(gè)iPSC衍生亞型特異性神經(jīng)細(xì)胞的脊髓損傷治療臨床試驗(yàn)現(xiàn)已正式啟動(dòng)���,標(biāo)志著再生醫(yī)學(xué)領(lǐng)域邁入全新階段的重要里程碑�����。該研究有望為長(zhǎng)期缺乏有效干預(yù)手段的脊髓損傷患者����,提供一種具有突破創(chuàng)新價(jià)值的“現(xiàn)貨型”細(xì)胞治療新選擇。
本次臨床試驗(yàn)將與大連醫(yī)科大學(xué)附屬第一醫(yī)院緊密協(xié)作�����,充分發(fā)揮雙方在中樞神經(jīng)疾病臨床研究方面的雄厚實(shí)力與平臺(tái)資源����,確保試驗(yàn)按國(guó)際高標(biāo)準(zhǔn)、高質(zhì)量推進(jìn)�����。我們致力于構(gòu)建具有全球引領(lǐng)力的“中國(guó)方案”��,為中樞神經(jīng)系統(tǒng)再生修復(fù)開(kāi)辟創(chuàng)新路徑��。
大連醫(yī)科大學(xué)附屬第一醫(yī)院黨委書(shū)記劉晶教授在注冊(cè)臨床啟動(dòng)會(huì)表示:iPSC衍生亞型神經(jīng)細(xì)胞國(guó)家Ⅰ類(lèi)新藥成功通過(guò)中美“雙報(bào)”注冊(cè)審批�����,標(biāo)志著我國(guó)在干細(xì)胞藥物研發(fā)與臨床轉(zhuǎn)化領(lǐng)域躋身世界前沿��,體現(xiàn)了中國(guó)原創(chuàng)生物醫(yī)藥在國(guó)際舞臺(tái)上的競(jìng)爭(zhēng)力與影響力�����。
新技術(shù)的臨床價(jià)值落地���,離不開(kāi)高水平臨床研究的支撐���。本次臨床研究選址中山大學(xué)附屬第三醫(yī)院與大連醫(yī)科大學(xué)附屬第一醫(yī)院,既是對(duì)兩家單位在干細(xì)胞研發(fā)能力��、臨床管理體系等方面的高度認(rèn)可����,也將成為對(duì)粵遼兩地干細(xì)胞治療體系建設(shè)成效的重要檢驗(yàn)。
大醫(yī)一院將與中山三院緊密協(xié)同�,推進(jìn)項(xiàng)目規(guī)范有序?qū)嵤η笠愿咚?����、高質(zhì)量的研究實(shí)踐��,為中樞神經(jīng)損傷修復(fù)領(lǐng)域的全球突破貢獻(xiàn)兼具科學(xué)性與創(chuàng)新性的“中國(guó)方案”��。
全球脊髓損傷患者群體人數(shù)眾多(約1500萬(wàn)人)���,其中��,中國(guó)脊髓損傷患者超過(guò)300萬(wàn)��,每年新增急性/亞急性損傷病例10萬(wàn)例�,平均每小時(shí)新增10例脊髓損傷患者。脊髓一旦受損����,極易造成患者全身或部分癱瘓、失去運(yùn)動(dòng)和感覺(jué)功能�����,包括四肢癱瘓(高位損傷)或下肢癱瘓(低位損傷)���,多數(shù)患者終身殘疾,嚴(yán)重影響生活質(zhì)量�。由于中樞神經(jīng)系統(tǒng)再生能力極低,神經(jīng)修復(fù)極為困難����,目前治療手段仍以康復(fù)訓(xùn)練和輔助支持為主,缺乏損傷期神經(jīng)再生修復(fù)方法���。
本項(xiàng)中美藥監(jiān)局雙報(bào)雙批的注冊(cè)臨床試驗(yàn)完成“全球首例”患者給藥���,是全球中樞神經(jīng)損傷修復(fù)領(lǐng)域的重要里程碑����,對(duì)探索再生脊髓神經(jīng)細(xì)胞移植治療脊髓損傷的安全性并分析對(duì)脊髓損傷患者療效的影響具有重要的標(biāo)桿意義���。
士澤生物創(chuàng)始人李翔博士表示:“全球首例”脊髓損傷患者接受脊髓特化再生神經(jīng)細(xì)胞治療已在中國(guó)順利實(shí)施�,標(biāo)志著該領(lǐng)域?qū)崿F(xiàn)了具有里程碑意義的突破��,開(kāi)創(chuàng)了行業(yè)發(fā)展的新篇章��。我們對(duì)此充滿(mǎn)信心�����,并將繼續(xù)推動(dòng)異體通用“現(xiàn)貨型”iPSC衍生亞型神經(jīng)細(xì)胞技術(shù)�、新藥開(kāi)發(fā)和臨床研究的協(xié)同進(jìn)步,力爭(zhēng)在以脊髓損傷為代表的中樞神經(jīng)損傷修復(fù)治療領(lǐng)域?qū)崿F(xiàn)進(jìn)一步突破�,積極爭(zhēng)取該領(lǐng)域的全球話(huà)語(yǔ)權(quán)。
士澤生物為國(guó)內(nèi)細(xì)胞治療帕金森病的領(lǐng)軍藥企�,由士澤生物創(chuàng)始人李翔博士于2021年全職歸國(guó)創(chuàng)立。士澤生物專(zhuān)注于開(kāi)發(fā)臨床級(jí)��、異體通用�、“現(xiàn)貨型”iPSC衍生細(xì)胞藥用于治療神經(jīng)系統(tǒng)疾?��。–NS Diseases),并已經(jīng)實(shí)現(xiàn)了顯著的領(lǐng)先優(yōu)勢(shì):
士澤生物已獲得中國(guó)國(guó)家藥監(jiān)局(NMPA)和美國(guó)食品藥品監(jiān)督管理局(U.S.FDA)正式批準(zhǔn)的七項(xiàng)中美注冊(cè)臨床試驗(yàn)批件��,多款通用型iPSC衍生神經(jīng)細(xì)胞新藥已處于中美注冊(cè)臨床試驗(yàn)階段���,包括用于治療:
全球第二大神經(jīng)退行性疾病原發(fā)性帕金森?��。ㄖ忻雷?cè)臨床I期);早發(fā)性帕金森?����。ㄖ袊?guó)注冊(cè)臨床I/II期)�;重大神經(jīng)系統(tǒng)疾病脊髓損傷(中美注冊(cè)臨床I期);肌萎縮側(cè)索硬化癥/漸凍癥(中國(guó)注冊(cè)臨床I/II期及美國(guó)注冊(cè)臨床I期)���,為中國(guó)首個(gè)自主iPSC衍生細(xì)胞藥獲美國(guó)FDA認(rèn)證并授予全球孤兒藥資格。
在通用iPSC細(xì)胞治療帕金森病賽道方向上��,士澤生物率先取得多項(xiàng)領(lǐng)域突破進(jìn)展�,與國(guó)內(nèi)最頂級(jí)醫(yī)院帕金森病專(zhuān)家聯(lián)合開(kāi)展注冊(cè)臨床試驗(yàn)合作:
2024年,“中國(guó)首個(gè)”iPSC衍生細(xì)胞治療神經(jīng)系統(tǒng)疾病的國(guó)家級(jí)備案臨床研究獲批���,與上海市東方醫(yī)院劉中民院長(zhǎng)團(tuán)隊(duì)合作����,完成包括“中國(guó)首例”在內(nèi)的多例帕金森病患者GCP/GMP級(jí)細(xì)胞治療,隨訪(fǎng)超過(guò)12個(gè)月:安全性良好����,患者“開(kāi)關(guān)期時(shí)間”、MDS-UPDRS評(píng)分及多項(xiàng)非運(yùn)動(dòng)指標(biāo)顯著改善��,多例患者反饋明顯的生活質(zhì)量提升�����,并通過(guò)國(guó)家衛(wèi)健委GCP/GMP規(guī)范雙核查����;
2025年,美國(guó)食品藥品監(jiān)督管理局(FDA)已一次性無(wú)發(fā)補(bǔ)完全正式批準(zhǔn)了士澤生物的通用型iPSC衍生多巴胺能神經(jīng)前體細(xì)胞注射液的研究性新藥申請(qǐng)(Investigational New Drug, IND)���,用于治療美國(guó)帕金森病的注冊(cè)臨床I期試驗(yàn)����。同月��,美國(guó)FDA批準(zhǔn)美國(guó)BlueRock Therapeutics公司(已于2019年被德國(guó)拜耳集團(tuán)全資收購(gòu))通用細(xì)胞治療帕金森病直接豁免注冊(cè)臨床II期、進(jìn)入確證臨床III期試驗(yàn)���。
2025年�����,“中國(guó)首個(gè)”由國(guó)家級(jí)神經(jīng)疾病醫(yī)學(xué)中心——北京天壇醫(yī)院馮濤主任牽頭��,聯(lián)合北京協(xié)和醫(yī)院包新杰主任/王任直主任/王含主任開(kāi)展的異體通用“現(xiàn)貨型”iPSC衍生多巴胺能神經(jīng)前體細(xì)胞(XS411注射液)注冊(cè)臨床I期試驗(yàn)���,用于治療全球第二大神經(jīng)退行性疾病原發(fā)性帕金森病��;
2025年�����,“中國(guó)首個(gè)”采用證據(jù)級(jí)別最高的“隨機(jī)雙盲對(duì)照”設(shè)計(jì)的注冊(cè)臨床I/II期試驗(yàn)���,由復(fù)旦大學(xué)附屬華山醫(yī)院(同為國(guó)家級(jí)神經(jīng)疾病醫(yī)學(xué)中心)王堅(jiān)主任/陳亮主任/張菁主任牽頭�����,聯(lián)合蘇州大學(xué)附屬第二醫(yī)院劉春風(fēng)主任開(kāi)展��,用于治療早發(fā)性帕金森?。‥OPD)�����。
此外�����,士澤生物開(kāi)發(fā)的其他異體通用iPSC細(xì)胞治療神經(jīng)系統(tǒng)疾病新藥同樣取得了具有突破性意義的里程碑進(jìn)展�����,處于“全球首款”及“全球首創(chuàng)”地位:
2023年���,“中國(guó)首個(gè)”iPSC衍生細(xì)胞藥(XS228注射液)獲得美國(guó)FDA認(rèn)證并授予全球孤兒藥資格��;
2024年��,“全球首款”iPSC衍生細(xì)胞(XS228注射液)治療漸凍癥(ALS)的國(guó)家級(jí)備案臨床研究獲批��,與東方醫(yī)院合作完成包括“全球首例”在內(nèi)的多例患者治療��,安全性良好�,初步顯示可有效延緩疾病進(jìn)程;
2025年���,“全球首個(gè)(FIC)”異體通用“現(xiàn)貨型”iPSC衍生亞型神經(jīng)前體細(xì)胞新藥的注冊(cè)臨床I期試驗(yàn)��,由中山大學(xué)附屬第三醫(yī)院戎利民院長(zhǎng)牽頭���,聯(lián)合大連醫(yī)科大學(xué)附屬第一醫(yī)院劉晶院長(zhǎng)開(kāi)展,用于治療重大神經(jīng)系統(tǒng)疾病脊髓損傷(SCI)�����,完成“全球首例”再生亞型神經(jīng)細(xì)胞治療脊髓損傷患者給藥���。
2025年�,“全球首個(gè)(FIC)”異體通用“現(xiàn)貨型”iPSC衍生亞型神經(jīng)前體細(xì)胞新藥(XS228注射液)的注冊(cè)臨床I/II期試驗(yàn)���,由北京大學(xué)第三醫(yī)院樊東升主任牽頭�,用于治療“世界四大絕癥之一”漸凍癥(ALS)��。
士澤生物為江蘇省雙創(chuàng)團(tuán)隊(duì)領(lǐng)軍企業(yè)����,姑蘇重大創(chuàng)新團(tuán)隊(duì)企業(yè)�、姑蘇創(chuàng)新創(chuàng)業(yè)領(lǐng)軍人才企業(yè)�、上海市東方英才計(jì)劃企業(yè)�����、上海市春申計(jì)劃杰出引進(jìn)人才企業(yè)等���;連續(xù)獲評(píng)中國(guó)潛在獨(dú)角獸及江蘇省潛在獨(dú)角獸企業(yè)��;連續(xù)兩年獲得國(guó)家科技部全國(guó)顛覆性技術(shù)創(chuàng)新大賽優(yōu)勝獎(jiǎng)(最高獎(jiǎng))等����;獲我國(guó)《新華日?qǐng)?bào)》《科技日?qǐng)?bào)》《科創(chuàng)板日?qǐng)?bào)》等多次報(bào)道���。
士澤生物已完成由頂級(jí)市場(chǎng)化風(fēng)險(xiǎn)投資機(jī)構(gòu)集體領(lǐng)投的多輪數(shù)億元融資:由峰瑞資本�、啟明創(chuàng)投�����、禮來(lái)亞洲基金�、紅杉中國(guó)、泰瓏/泰鯤資本等多家知名市場(chǎng)化機(jī)構(gòu)領(lǐng)投及多輪持續(xù)投資,其中包括2022-2025年在生物醫(yī)藥領(lǐng)域寒冬期的4億元A1/A2/B1/B2輪市場(chǎng)化融資�����。