2025年4月17日,聚焦于基因和細(xì)胞治療的上海邦耀生物科技有限公司(以下簡(jiǎn)稱“邦耀生物”)宣布���,其基于具有自主知識(shí)產(chǎn)權(quán)的通用型細(xì)胞平臺(tái)(TyUCell?)開發(fā)的新一代異體CAR-T產(chǎn)品“靶向CD19基因修飾的異體嵌合抗原受體T細(xì)胞注射液”(管線代號(hào):BRL-301)針對(duì)“復(fù)發(fā)/難治性B細(xì)胞非霍奇金淋巴瘤(R/R B-NHL)”的新適應(yīng)癥臨床試驗(yàn)申請(qǐng)(IND)���,于今日正式獲得中國國家藥品監(jiān)督管理局藥品審評(píng)中心(CDE)批準(zhǔn)。這是繼2023年7月��,BRL-301在急性淋巴細(xì)胞白血?����。ˋLL)領(lǐng)域取得里程碑進(jìn)展��,獲得CDE的IND批準(zhǔn)(受理號(hào):CXSL2300315)后�����,邦耀生物在血液腫瘤治療領(lǐng)域的又一重大突破�����,標(biāo)志著該產(chǎn)品向覆蓋更廣泛B細(xì)胞惡性腫瘤適應(yīng)癥的目標(biāo)邁出關(guān)鍵一步�����。
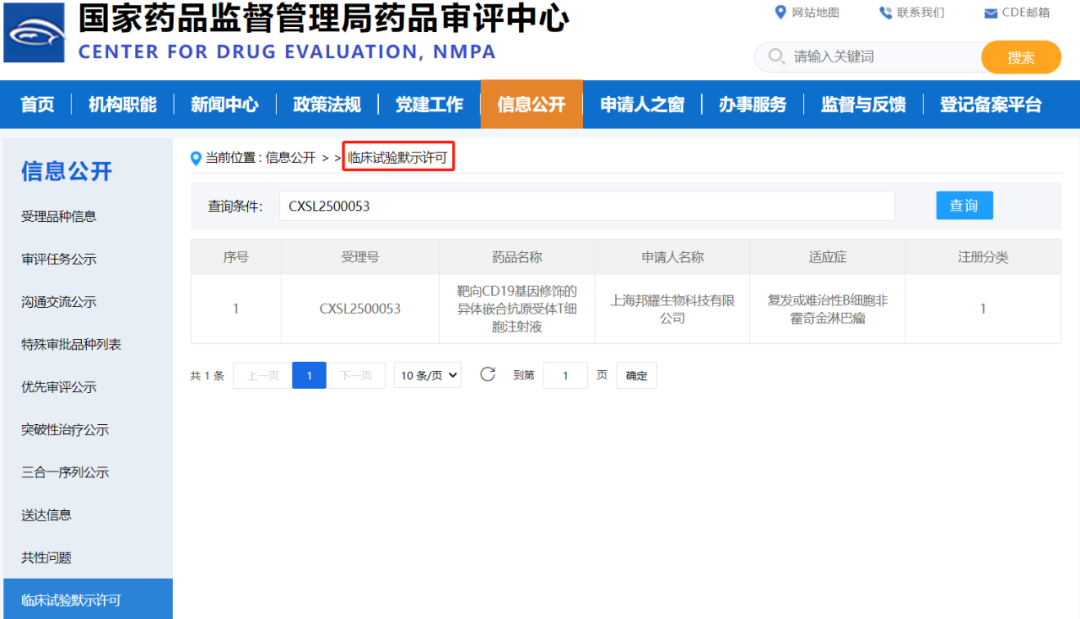
CDE獲批截圖
填補(bǔ)臨床空白���!BRL-301 UCAR-T為R/R B-NHL患者帶來新希望
B細(xì)胞非霍奇金淋巴瘤(B-NHL)是一組來源于B淋巴細(xì)胞��,發(fā)生在淋巴結(jié)和/或淋巴結(jié)外淋巴組織的具有明顯異質(zhì)性的惡性腫瘤��,占非霍奇金淋巴瘤(NHL)的75-93%����。大B細(xì)胞淋巴瘤��,包括彌漫性大B細(xì)胞淋巴瘤��、原發(fā)性縱隔B細(xì)胞淋巴瘤和轉(zhuǎn)化型濾泡淋巴瘤�����,診斷明確后會(huì)采取聯(lián)合化學(xué)免疫治療��,60%的晚期患者可接受R-CHOP(如利妥昔單抗、環(huán)磷酰胺����、多柔比星等)免疫化療方案,但R-CHOP治療失敗的患者通常預(yù)后不佳���,尤其是復(fù)發(fā)/難治性患者預(yù)后極差��。除了傳統(tǒng)免疫化療���,還有靶向治療及自體CAR-T療法對(duì)R/R B-NHL患者治療響應(yīng)率有限,且存在治療周期長�、毒性反應(yīng)大、成本高昂等挑戰(zhàn)��。因此�����,對(duì)于無法耐受高強(qiáng)度治療或自體T細(xì)胞質(zhì)量不佳的腫瘤患者���,亟需更安全����、可及性更高的創(chuàng)新療法�。
BRL-301基于全球領(lǐng)先的通用型細(xì)胞平臺(tái)TyUCell?,由邦耀生物創(chuàng)始人&董事長��、華東師范大學(xué)劉明耀教授以及杜冰教授領(lǐng)銜的科學(xué)家團(tuán)隊(duì)從2016年開始?xì)v經(jīng)8年科研攻關(guān)��、多次技術(shù)迭代���,所研發(fā)的全新一代異體通用型CAR-T技術(shù)���。主要通過多重基因編輯技術(shù)實(shí)現(xiàn)異體T細(xì)胞的免疫逃逸和功能優(yōu)化,從源頭規(guī)避移植物抗宿主?��。℅VHD)和宿主排斥(HVG)風(fēng)險(xiǎn)���,還完美攻克了異體通用型CAR-T產(chǎn)品開發(fā)中最關(guān)鍵的技術(shù)壁壘:患者免疫系統(tǒng)對(duì)異體細(xì)胞的排異,在保障細(xì)胞產(chǎn)品安全性和有效性的基礎(chǔ)上�,真正實(shí)現(xiàn)了免疫細(xì)胞治療產(chǎn)品的通用化。此次獲批的適應(yīng)癥擴(kuò)展進(jìn)一步驗(yàn)證了該UCAR-T技術(shù)在多適應(yīng)癥開發(fā)中的潛力��。
可以說�����,與國內(nèi)外同類型產(chǎn)品相比,BRL-301 UCAR-T療法具有三大核心優(yōu)勢(shì):
1.突破可及性瓶頸��,惠及更廣泛患者群體
BRL-301作為“現(xiàn)貨型”通用CAR-T產(chǎn)品�,無需患者自體細(xì)胞采集和定制化生產(chǎn),單批次可滿足200例以上治療需求���,不僅極大降低了生產(chǎn)成本��,還顯著縮短了患者等待時(shí)間����。其無需HLA配型的特性�,尤其適用于病情進(jìn)展迅速或自體細(xì)胞功能受損的R/R B-NHL患者,為傳統(tǒng)療法失敗者提供“及時(shí)雨”式治療選擇���。
2.安全性再獲驗(yàn)證�,降低治療風(fēng)險(xiǎn)
BRL-301產(chǎn)品無需對(duì)患者進(jìn)行額外的清淋或者免疫抑制�,僅采用常規(guī)甚至更低的清淋方案,就可以實(shí)現(xiàn)腫瘤細(xì)胞的完全清除�,還能夠有效避免對(duì)患者過度免疫抑制所帶來的感染、粒細(xì)胞缺乏�、淋巴細(xì)胞恢復(fù)慢等風(fēng)險(xiǎn)。早期臨床試驗(yàn)數(shù)據(jù)表明����,接受治療的患者未發(fā)生≥3級(jí)的細(xì)胞因子釋放綜合征(CRS)或神經(jīng)毒性(ICANS)�����,感染發(fā)生率較同類產(chǎn)品更低,印證了其卓越的臨床安全性��。
3.持久緩解�,療效顯著提升
邦耀生物通過精選健康供體T細(xì)胞并優(yōu)化擴(kuò)增工藝,使BRL-301在體內(nèi)具備更強(qiáng)的增殖能力和長效存續(xù)性����。在產(chǎn)品前期的臨床試驗(yàn)研究中,BRL-301已經(jīng)表現(xiàn)出顯著且持久的腫瘤清除能力���,受試腫瘤患者全部達(dá)到完全緩解(CR或CRi)�,在患者體內(nèi)表現(xiàn)出顯著的增殖和長期的持續(xù)性�����,為長期生存帶來可能��。
引領(lǐng)行業(yè)革新��,加速產(chǎn)業(yè)化進(jìn)程
邦耀生物創(chuàng)始人&董事長劉明耀教授表示:“BRL-301在血液腫瘤領(lǐng)域針對(duì)復(fù)發(fā)/難治性B細(xì)胞急性淋巴細(xì)胞白血病(R/R B-ALL)和復(fù)發(fā)/難治性B細(xì)胞非霍奇金淋巴瘤(R/R B-NHL)雙適應(yīng)癥的快速推進(jìn),體現(xiàn)了邦耀生物新一代異體通用型CAR-T在解決行業(yè)痛點(diǎn)上的巨大優(yōu)勢(shì)����。此外,我們基于該UCAR-T技術(shù)在自身免疫疾病治療中也取得了世界首個(gè)突破性進(jìn)展���,極具革命性意義����。未來��,我們將積極推動(dòng)該技術(shù)產(chǎn)品的轉(zhuǎn)化落地����,造福廣大患者?���!?/span>
目前,邦耀生物將同步推進(jìn)BRL-301在中國多中心的臨床試驗(yàn)�,并積極探索異體通用UCAR-T技術(shù)在血液腫瘤,實(shí)體瘤及自身免疫疾病中的應(yīng)用���?�?梢哉f����,此次IND獲批不僅為復(fù)發(fā)難治性淋巴瘤(R/R B-NHL)患者開辟了生命新通道,更將推動(dòng)中國創(chuàng)新細(xì)胞治療技術(shù)邁向國際領(lǐng)先地位�����。
上海邦耀生物科技有限公司致力于成為新商業(yè)文明時(shí)代全球領(lǐng)先的細(xì)胞基因藥企���,邦耀生物以“以基因編輯技術(shù)引領(lǐng)創(chuàng)新,開發(fā)突破性療法����,造福全人類”為使命,依托自主研發(fā)中心及與高校共建的“上?����;蚓庉嬇c細(xì)胞治療研究中心”�,目前已產(chǎn)生100多項(xiàng)專利成果,有19個(gè)項(xiàng)目在20余家知名醫(yī)院開展臨床試驗(yàn)����,5個(gè)項(xiàng)目已獲批IND�,正式進(jìn)入注冊(cè)臨床試驗(yàn)階段���,還有多個(gè)項(xiàng)目進(jìn)入IND申報(bào)階段��。其中��,基因編輯治療β-地中海貧血癥�����、非病毒定點(diǎn)整合PD1-CAR-T�、以及UCAR-T等項(xiàng)目已經(jīng)取得優(yōu)異臨床效果���,具有全球領(lǐng)先性�����,并在Nature�����、Cell�����、Nature Medicine��、Nature biotechnology等知名學(xué)術(shù)期刊上發(fā)表多篇學(xué)術(shù)論文���。邦耀生物已搭建基因編輯技術(shù)創(chuàng)新平臺(tái)���、造血干細(xì)胞平臺(tái)、非病毒定點(diǎn)整合CAR-T平臺(tái)���、通用型細(xì)胞平臺(tái)、增強(qiáng)型T細(xì)胞平臺(tái)五大具有自主知識(shí)產(chǎn)權(quán)的技術(shù)平臺(tái)�����,擁有7000平米GMP中試基地及近100人的運(yùn)營團(tuán)隊(duì)����,有力保障創(chuàng)新的研究成果能夠快速轉(zhuǎn)化與應(yīng)用。邦耀生物通過患者需求和臨床反饋不斷推動(dòng)研發(fā)產(chǎn)品快速更新迭代�����。并秉持開放、共享��、共贏的態(tài)度�����,與全球創(chuàng)新生物醫(yī)藥生態(tài)鏈企業(yè)一起�,加快推進(jìn)創(chuàng)新藥物的轉(zhuǎn)化與落地,造福全球遺傳疾病�、惡性腫瘤及自身免疫系統(tǒng)疾病等患者!